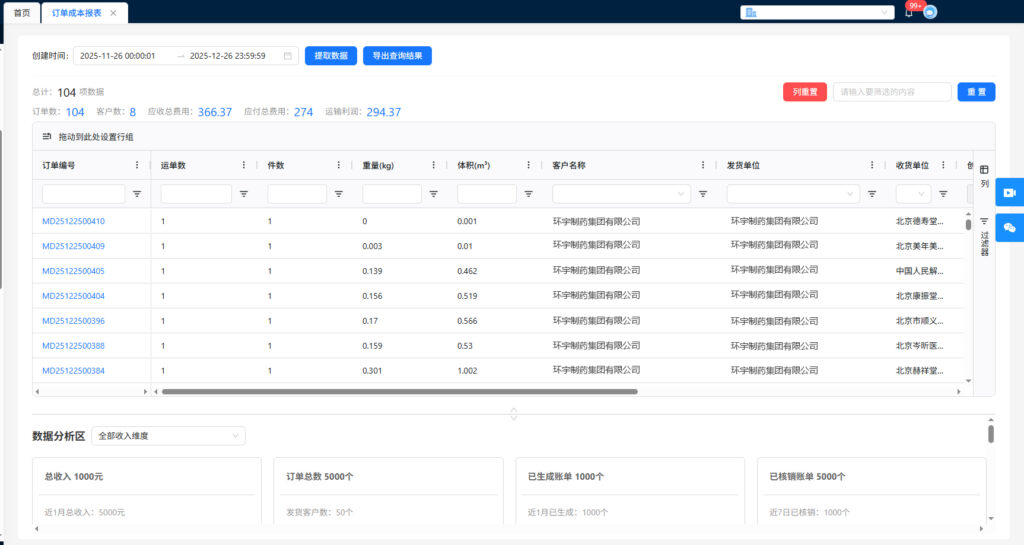
2024年12月31日,江苏省药监局发布《关于进一步做好药品经营监督管理有关工作的通知》(以下简称《通知》),本通知自2025年2月1日起施行,有效期至2030年1月31日。
《通知》共分为四个部分21条,主要从规范药品经营许可管理、规范药品经营行为、规范委托销售报告和委托储存管理等方面,做出具体规定。
一、药品经营许可管理新要求
江苏省药监局最新发布的《通知》对药品经营许可管理进行了全面规范。新规要求,所有药品经营企业必须在2025年10月1日前完成新版许可证的换发工作。企业可选择单独申请换证,也可与变更、重新审查发证等事项合并办理。值得注意的是,新版许可证的编号体系进行了重大调整。编号格式为”苏+两位分类代码+四位地区代码+五位顺序号”,其中分类代码和地区代码的设置充分考虑了企业类型和地域分布。
两位分类代码为大写英文字母,第一位A表示批发企业,B表示药品零售连锁总部,C表示零售连锁门店,D表示单体药品零售企业;第二位A表示法人企业,B表示非法人企业。
四位地区代码对应企业所在设区市代码,按照国内电话区号编写,保留三位区号,区号为四位的去掉第一个0,第四位为所在地区的调整码,药品批发企业和药品零售连锁总部调整码为0,药品零售企业(连锁门店、单体药店)调整码依据所在区县从a开始依次按英文字母顺序进行编制(字母o不使用)。许可证编号顺序号应当在确定分类代码、地区代码后,分别从00001开始编制。
二、经营范围与经营方式调整
新规对药品经营范围进行了统一规范。其中,”化学药制剂、化学原料药”统一调整为”化学药”;”体外诊断试剂”调整为”体外诊断试剂(药品)”;精神药品细分为”第一类精神药品”和”第二类精神药品”。对于经营冷藏、冷冻药品的企业,需在经营范围后特别标注。
如:药品经营企业经营冷藏、冷冻药品的,在经营范围后标注“以上含冷藏药品”“以上含冷冻药品”“以上含冷藏、冷冻药品”。药品批发企业经营罂粟壳的,在“麻醉药品”经营范围中予以单独标注,如“麻醉药品(含罂粟壳)”;药品零售企业仅经营独立包装单味中药饮片的,经营范围单独标注为“中药饮片(仅限独立包装单味中药饮片)”。
经营方式方面,新规要求明确标注”批发”、”零售(连锁总部)”、”零售(连锁门店)”或”零售(单体)”。这一调整有助于监管部门更精准地掌握企业经营状况,提高监管效率。
三、药品购销与经营行为规范
在药品购销环节,新规对特殊购药需求进行了明确规定。科研、检验检测、慈善捐助、突发公共卫生事件等有特殊购药需求的单位需向当地监管部门报告,并向报告中指定的药品上市许可持有人或者药品经营企业购买药品。购药单位报告应至少包括但不限于以下内容:购买双方合法资质证明性材料,购药数量、用途及相关证明性材料,剩余药品处置措施等。
对于疫苗、麻醉药品等特殊管理药品,必须严格执行国家相关规定。药品零售连锁企业的采购和配送也受到严格规范。总部必须统一采购,并通过自有配送中心直接配送至门店。委托储存和配送的企业,需每年至少进行一次质量审核,确保药品质量安全。
四、委托销售与储存管理
新规对药品委托销售和储存管理提出了更高要求。药品上市许可持有人委托销售或储存药品时,需向相关监管部门报告,并提供完整的委托协议和资质证明材料。跨省委托的,还需同时报告受托方所在地监管部门。
对于接受委托储存业务的药品批发企业,必须符合《办法》相关规定,并具备相应的质量管理体系和现代物流设施。特别是接受多家企业委托的,必须确保能够通过信息化系统对药品进行明确区分,防止混淆与差错。
五、监管要求与实施保障
为确保新规有效实施,各级药品监管部门将加强监管力度。重点包括:
1. 强化药品追溯体系建设,特别是国家集采中选品种和生物制品
各级药品监管部门要以国家集采中选品种、生物制品等品种为重点,以省级药品追溯监管平台为辅助,督促企业和医疗机构建立药品追溯制度,落实药品追溯责任,加快推进全过程药品信息化追溯。
2. 推进执业药师在岗服务管理的信息化监测
要积极探索采用信息化手段对执业药师等药学技术人员在岗服务管理情况进行监测,提升药学服务水平。
3. 制定配套文件,完善工作流程和标准
地药品监管部门要依据《办法》《公告》和本通知要求,结合工作实际制定必要的配套文件,围绕严格经营许可准入、强化经营活动监管、健全检查机制、提高协同监管和治理水平等方面细化要求,完善工作流程和标准,切实提升药品经营监管效能。
新规自2025年2月1日起施行,有效期至2030年1月31日。在此期间,各级监管部门将持续关注执行情况,及时解决实施过程中遇到的问题,确保药品经营监管工作稳步推进。